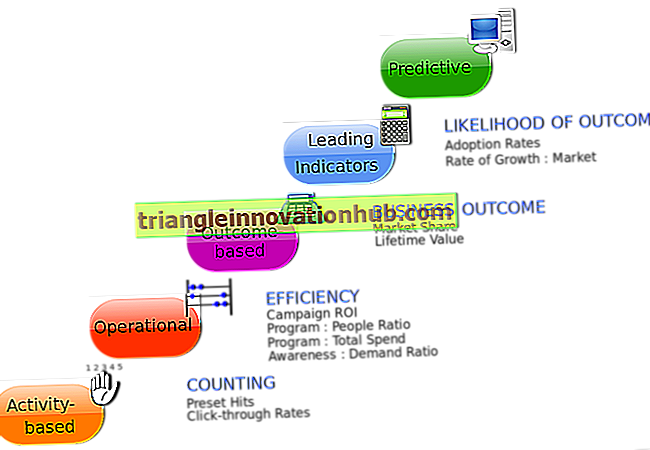
أهمية التمثيل الغذائي للدهون: ردود الفعل على التحلل الإنزيمي في الجلسرين
أهمية التمثيل الغذائي للدهون: ردود الفعل على التحلل الإنزيمي في الجلسرين!
الخطوة الأولى في تحلل الدهون هي الهضم ، أي التحلل الإنزيمي إلى الجلسرين والأحماض الدهنية ، مع الليباز مثل الإنزيم المحدد.
قد يتم بعد ذلك فوسفرة من الجليسيرول بواسطة ATP وتؤكسد إلى phosphoglyceraldehyde ، PGAL.

تتطلب هذه العملية ATP واحدًا للفسفرة ولكن ينتج 3 ATP في نقل H2 من NAD إلى 0 2 . قد تشارك PGAL فيما بعد في التسلسل المعتاد للتمثيل الغذائي للكربوهيدرات عن طريق تحلل السكر ودورة كريب ، وهي عملية تنتج 17 ATP لكل جزيء واحد. وهكذا ، يحقق التنفس الهوائي الكامل لجزيء واحد من الغليسيرول ربحًا صافيًا إجماليًا قدره 19 ATP.
أكسدة بيتا للأحماض الدهنية:
يُعرف التحلل التنفسي للأحماض الدهنية باسم أكسدة بيتا التي تحدث في الأنسجة الدهنية والكبد. تم اكتشاف الآلية لأول مرة من قبل فرانز نوب. في هذه الأكسدة ، يخضع ثاني أو ف- كربون من الأحماض الدهنية إلى تغيرات مؤكسدة تؤدي إلى تقسيم شظايا الكربون المتعاقبة المتتالية من سلسلة من الأحماض الدهنية حتى تبقى الجزء الأخير من الكاربون. تحدث الإنزيمات المطلوبة في أكسدة P في الميتوكوندريا.
1. تفعيل الأحماض الدهنية:
في البداية يتم ربط جزيء الحمض الدهني بشكل نهائي مع CoA ، ATP الذي يوفر الطاقة اللازمة.

2. نزع الهيدروجين من حامض المنشط:
في إزالة الهيدروجين ، تتم إزالة H واحدة من كل من كربون a-and-carbons وتشكل رابطة ثنائية غير مشبعة ، —CH = CH—. الناقل الهيدروجيني المحدد في هذا التفاعل هو FAD.

3. الماء:
هذا يحل الرابطة المزدوجة غير المشبعة وينتج مجموعة كحولية على β-carbon.

4. تحويل مشتق β-Hydroxyl Acyl إلى β-Keto-derivative:
يتم تحفيز هذا التفاعل بواسطة الإنزيم ، β-hydroxyl acyl-dehydrogenase ، ويعمل NAD كمستقبل الهيدروجين. هذه هي الأكسدة from التي يشتق منها التسلسل بأكمله اسمها.

5. تفاعل β-Keto-acyl CoA مع CoA:
يتم تحفيز هذا التفاعل بواسطة ثيولاز P-keto-acyl ويؤدي إلى تكوين acetyl-CoA وحمض دهني منشط يكون أقصر بـ 2 ذرة كربون من مركب التنشيط الذي يتكون في تفاعل 1 ، في بداية التسلسل الكامل. وقد يصبح المركب الأقصر الآن مؤكسدًا في دورته الخاصة ، وقد يتم قطع جزيئات الأسيتيل-CoA المتتالية.


قد يتأكسد Acetyl-CoA الناتج في انهيار الأحماض الدهنية في وقت لاحق إلى C02 و H 2 0 عن طريق دورة Kreb.
عائد الطاقة خلال أكسدة بيتا:
في الأكسدة، ، يؤدي نقل H2 من FAD إلى O 2 إلى تحقيق 2ATP (وليس 3 ، حيث يتم تجاوز خطوة NAD) ونقل مماثل من NAD ينتج 3 ATP. وبالتالي هناك مكاسب من 5 ATP لكل جزيء من الأسيتيل COA شكلت. إذا ، على سبيل المثال ، نفترض أن حامض الستاريك (C 18 ) هو وقود البدء الفعلي ، إذن ، p- أكسدة هذا الحامض الدهني قد يحدث على التوالي ثماني مرات ، مما يؤدي إلى الحصول على الأسيتيل CoA في كل مرة ويترك تاسيل أسيتيل كباقي.
عند 5 ATP لكل p-oxidation ، يكون المحصول بالتالي 5 x 8 = 40 ATP ، ناقص 1 ATP يتم إنفاقه للتفعيل الأصلي لجزيء حمض stearic free. ولذلك ينتج واحد من الأحماض الدهنية C 18 شبكة من 39 جزيء ATP و 9 Acetyl CoA. هذا الأخير يولد 9 × 12 أو 108 جزيء ATP في دورة كريب ، بحيث تكون الطاقة الكلية المكتسبة من التنفس الكامل لحمض دهني هو 147 جزيء ATP.
بالمقارنة مع 38 ATP ينتج من جزيء جلوكوز واحد ، (C 6 ) ، ينتج حمض stearic (C 18 ) 147 جزيء ATP. وبالتالي من الواضح أن الأحماض الدهنية هي مصدر أغنى للطاقة القابلة للاستخدام من الكميات المعادلة من الكربوهيدرات. هذا هو السبب في أن الدهون هي الأطعمة المفضلة لتخزين الحيوانات ولماذا هي عملية الأيض الحيواني عالية الدهون.
Ox أكسدة الأحماض الدهنية:
تم إثبات أكسدة الأحماض الدهنية طويلة السلسلة إلى أحماض α-hydroxy مع واحد من الكربون أقل من الركيزة الأصلية في microsomes من الدماغ والأنسجة الأخرى وفي النباتات ، والأحماض الدهنية سلسلة طويلة α- هيدروكسي هي مكونات الدهون في الدماغ. ويمكن تحويل هذه الأحماض الدهنية الهيدروكسي إلى أحماض ألفا كيتو ، تليها إزالة الكربوكسيل التأكسدي ، مما يؤدي إلى تشكيل الأحماض الدهنية طويلة السلسلة مع عدد فردي من ذرات الكربون.
RCH 2 —CH2 —CH 2 —COOH–> RCH 2 —CH2 —CHOH — COOH →
RCH 2 —CH 2 —CO — COOH–> RCH 2 —CH 2 —COOH + CO 2
يتم تحفيز خطوة a-hydroxylation الأولية بواسطة monooxygenase الذي يتطلب 0 2 ، Fe 2+ وحامض الأسكوربيك أو tetrahydropstine. يتم تحفيز تحويل حمض a-hydroxy إلى a-keto a-keto acid بواسطة إنزيم نيدروجيناز خاص بـ NAD. يشمل نزع الكربوكسيل النهائي NAD ، ATP وحامض الأسكوربيك.
Ox أكسدة الأحماض الدهنية:
الأحماض الدهنية لمتوسط طول السلسلة ، وبدرجة أقل ، الأحماض الدهنية طويلة السلسلة قد تخضع في البداية للأكسدة لأحماض ɯ-hydroxy الدهنية التي يتم تحويلها لاحقا إلى أحماض d-dicarboxylic. وقد لوحظ هذا مع الانزيمات في microsomes الكبد ومع الاستعدادات انزيم قابل للذوبان من البكتيريا.
في الكبد ، يتم تحفيز التفاعل الأولي بواسطة مونوكسيجيناز ، الذي يتطلب O 2 و NADPH 2 و السيتوكروم P 450 . يحل فيرودوكسين محل المركب الأخير في الميكروبات. بمجرد تشكيل ، يمكن تقصير حمض ثنائي الكربوكسيل من أي من نهاية الجزيء بواسطة تسلسل الأكسدة β.
كفاءة التنفس الدهني:
وبغض النظر عن زيادة محتوى الطاقة من الدهون ، فإن كفاءة التنفس الدهني معادلة تقريبًا لمادة الكربوهيدرات ، أي حوالي 40٪.
التخليق الحيوي للأحماض الدهنية والدهون:
معظم الكائنات الحية ، بما في ذلك الإنسان ، قادرة على تخليق كل أحماضها الدهنية تقريباً من المواد غير الدهنية. مواد البناء هي الأسيتيل COA. بما أن الكربوهيدرات والبروتينات يمكن أن تتحلل أيضيا إلى الأسيتيل COA ، فإنها قد توفر بوضوح السلائف لتشكيل الأحماض الدهنية.
يحدث التوليف في الشبكة الإندوبلازمية والسيتوبلازم ، وينطوي بشكل أساسي على الجمع بين وحدات الأسيتيل CoA لتشكيل جزيئات طويلة من سلسلة الكربون مع تحرير الإنزيم المساعد.
وهناك عدد من الانزيمات المختلفة وكذلك ATP ، NADPH ، أنزيم A ، فيتامين البيوتين ، وفيتامين ب 12 ضرورية في تركيب الأحماض الدهنية من الأسيتيل COA. تتفاعل الأحماض الدهنية المتشكلة مع فوسفات الجليسيرول ، الذي يتشكل عن طريق خفض ثنائي فوسفات ثنائي هيدروكسي الأسيتون ، أو الفسفرة المباشرة من الجلسرين مع ATP في وجود الجلسرين.

تحويل الدهون إلى الكربوهيدرات - دورة Glyoxylate:
على الرغم من أنه من الشائع ملاحظة أن الكربوهيدرات يتم تحويلها بسهولة إلى دهون في أنسجة الحيوانات ، فلا يوجد دليل على أن العكس هو بالتحديد تحويل الدهون إلى الكربوهيدرات. في الأنسجة النباتية ، ومع ذلك ، فإن البذور التي تحتوي على نسبة عالية من الدهون بسرعة تحويل رواسب الدهون إلى السكروز على الإنبات.
حتى الآونة الأخيرة لم يكن معروفا آلية تحويل الدهون إلى الكربوهيدرات. اكتشف هاري بيفيرز في أواخر الخمسينات وأوائل الستينات أن تحويل الدهون إلى السكريات حدث خلال دورة الغليوكسيلات. وقد أبلغت HL Kornberg و Krebs عن هذه الدورة في بعض الكائنات الحية الدقيقة التي تعيش في وسط يحتوي على الأسيتات كمصدر وحيد للكربون.
هذه الكائنات الدقيقة تلبي كل احتياجاتها من الطاقة من انهيار الأسيتات إلى CO ، والمياه عن طريق الأسيتيل CoA واستخدام ذلك الأسيتيل CoA لبناء السكريات والمواد الخلوية الأخرى.
دورة Glyoxylate هي بشكل أساسي تجاوز من دورة Kreb. في الواقع يتم تسهيل هذا المسار من خلال إنزيمات دورة كريب ، على الرغم من اثنين من الانزيمات ، isocitratase و synthetase malate شخصيا في هذا المسار.
تمر هذه الدورة من خلال 5 خطوات ومن هذه الثلاثة هي تفاعلات دورة كريب.
تفاعل 1:
(رد فعل دورة كريب). يدخل التميم COA الذي تم الحصول عليه من تحلل الدهون في دورة كريب عن طريق التفاعل مع حمض الأكسالاسيتيك لتشكيل حامض الستريك. سيترات sysnthetase آثار هذا التفاعل.

رد فعل 2:
(رد فعل دورة كريبس) حامض الستريك isomerized إلى حمض isocitric بواسطة dehydratase الأوني مع حمض cis-aconitic كما وسيطة.

تفاعل 3:
(تفاعل دورة الغليوكسيلات) هو مشقوق حمض Isocitric لتشكيل حمض السكسينيك وحمض الجلايكسيليك ، من خلال وساطة isocitratase.
حمض Isocitric → Isocitatase ، حمض الجلايكسيليك + حمض Succinic
تفاعل 4:
(رد فعل دورة الغليوكسيلات). يجمع حمض الجلايكسيليك مع أسيتيل COA آخر ويكوّن حمض الماليك بواسطة إنزيم synthetase الأنزيمي.

رد فعل 5:
(تفاعل دورة كريب) يتم تحويل حمض الماليك إلى حمض أوكسالاسيتيك من خلال ديهيدروجيناز الماليك.

يتم إرجاع حمض Oxaloacetic المستخدم في Reaction 1 لبدء الدورة هنا ، في Reaction 5. وهكذا بالنسبة لدورة واحدة من هذه الدورة ، يتم تحويل جزيئين أسيتيل CoA إلى حمض ثنائي الكربوكسيل ، مثل حمض succinic. يحتل حامض السكسينيك مكانة رئيسية لأنه يمكن استخدامه لإنتاج البورفيرينات ، الأميدات ، البيريميدين والأهم من السكريات.
عندما يتم استخدامه لإنتاج السكريات ، يتم تحويل حمض السكسينيك لأول مرة إلى حمض الأكسالوكسيتيك عن طريق تفاعل دورة كريبس. ثم يتم بعد ذلك إزالة ديكاربوكسيل إلى حمض فسفوينول بيروفينات (PPP) ، وهو وسيط من تحلل السكر. مع PEP كنقطة انطلاق عن طريق عكس مسار حال السكر ، تخليق الخلايا السكروز.

تقع دورة Glyoxylate في الميتوكوندريا في الخلايا التي تحتوي على القليل من الدهون. لكن في البذور الزيتية مثل الخروع ، اكتشف بيفيرز glyoxysomes ، عضيات خاصة تعمل كمقعد للدورة. الحيوانات لا تملك هذا الطريق. ذلك هو السبب؛ هم غير قادرين تماما على تحويل الدهون الكربوهيدرات. من ناحية أخرى ، فإن الكائنات الحية الدقيقة التي تعيش على الأسيتات ، لها هذه الدورة باعتبارها الآلية الوحيدة لتوليد السكريات.